NE LAISSER PAS LE 5G DETRUIRE VOTRE ADN Protéger toute votre famille avec les appareils Quantiques Orgo-Life® Publicité par Adpathway
Abstrait
Les troubles du spectre autistique (TSA), la schizophrénie et le trouble bipolaire sont des troubles neurodéveloppementaux (TND) génétiquement complexes et hétérogènes, résultant de facteurs génétiques et d’interactions gène-environnement (GxE) et dont l’apparition survient au début du développement cérébral. Des progrès récents mettent en évidence le lien entre les TSA et (i) l’immunogénétique, le neurodéveloppement et l’inflammation, et (ii) les troubles de l’autophagie, un processus neurodéveloppemental crucial impliqué dans l’élagage synaptique. Parmi les divers facteurs environnementaux à l’origine du risque de TSA, les vaccins contenant de l’aluminium (Al) injectés pendant les périodes critiques ont fait l’objet d’une attention particulière et ont suscité des questions scientifiques pertinentes. L’objectif de cette revue est de discuter des connaissances actuelles sur le rôle de l’inflammation précoce, du dysfonctionnement immunitaire et de l’autophagie dans les TSA, ainsi que des études précliniques qui s’interrogent sur l’impact des adjuvants aluminiques sur la maturation cérébrale et immunitaire. Nous mettons en lumière les avancées les plus récentes et le manque de données épidémiologiques, pharmacocinétiques et pharmacodynamiques, constituant une « lacune scientifique ». Nous proposons des recherches complémentaires, telles que des études génétiques qui pourraient contribuer à identifier les populations à risque génétique, à améliorer le diagnostic et potentiellement au développement de nouveaux outils thérapeutiques.Mots-clés:
Les troubles du spectre autistique (TSA), le trouble bipolaire (TB) et la schizophrénie (SZ) sont des troubles neurodéveloppementaux exceptionnels en raison de leur diagnostic complexe, de la pléthore de symptômes, des multiples comorbidités associées et de la diversité de leurs étiologies. Ils présentent tous les obstacles et limites qui compliquent la cartographie génétique, tels que l’hétérogénéité génétique, la pléiotropie, la fréquence élevée des allèles responsables de la maladie et les facteurs épigénétiques [
].Il est intéressant de noter que des preuves substantielles soutiennent l’influence de facteurs environnementaux sur la maturation cérébrale précoce, contribuant à des déficiences neuronales et cognitives durables. Que ce soit par toxicité directe ou par une altération de la régulation génétique, ces facteurs jouent un rôle clé dans la prévalence accrue des troubles neurodéveloppementaux signalés ces dernières décennies.Des études épidémiologiques ont suggéré que des dérèglements spécifiques et/ou l’activation du système immunitaire maternel pendant la grossesse constituent des facteurs de risque environnementaux cruciaux pour les TND chez l’enfant. Les infections maternelles peuvent être transmises verticalement au nourrisson et provoquer des infections cérébrales congénitales. De plus, les infections maternelles non transmissibles peuvent également impacter indirectement le développement cérébral du fœtus et augmenter le risque de TND, par activation immunitaire maternelle (AIM) [
.Le rôle de l’activation immunitaire précoce directe sur l’organisme en développement et le développement du NDD a été largement décrit [
, et les mécanismes moléculaires et cellulaires qui interviennent dans les altérations neurodéveloppementales liées à l’immunité apparaissent progressivement [
13 ].Français Pour étudier l’effet des impacts négatifs successifs et cumulatifs, les modèles « à coups multiples » [
14 ,
15 ] sont devenus une pratique courante, intégrant à la fois des facteurs génétiques et environnementaux contribuant potentiellement à la vulnérabilité au développement de ces troubles. Des études précliniques à coups multiples — telles que des activations immunitaires périnatales successives — ont déjà confirmé le risque accru pour la progéniture et ont largement contribué à démêler les mécanismes moléculaires et cellulaires qui médient les altérations cérébrales induites par l’immunité au cours du développement [
16 ,
Un autre modèle similaire considérait le contexte génétique comme le premier coup : les facteurs génétiques de l’individu interagissent avec l’exposome du début de la vie (y compris les polluants organiques persistants), qui peut être considéré en soi comme un deuxième coup [ . Ces deux coups se combinent pour former un phénotype dormant qui pourrait probablement être codifié dans l’épigénome et qui est vulnérable à un troisième coup environnemental plus tard dans la vie [
Ces observations ressemblent au phénomène bien décrit de l’amorçage microglial, l’état inflammatoire exagéré et la réponse des cellules gliales à leur microenvironnement Les cellules gliales amorcées conservent une morphologie plus active (par exemple, amiboïde ou réactive) en réaction à un stimulus de base, tel qu’une infection, un traumatisme ou le vieillissement. Cependant, comparées à la glie activée de manière aiguë, les cellules amorcées ne libèrent pas de cytokines et d’autres molécules pro-inflammatoires à long terme. Au lieu de cela, lorsqu’elles sont confrontées à un défi, les cellules amorcées génèrent plus de cytokines dans le cerveau que les cellules non amorcées [
Parmi la variété de facteurs environnementaux soupçonnés de contribuer à la physiopathologie des DND, les expositions précoces répétées aux vaccins contenant de l’aluminium (Al) pendant les périodes critiques du développement des systèmes nerveux et immunitaire ont reçu une attention particulière. Au cours des cinq dernières décennies, des inquiétudes croissantes ont été soulevées au sein de la communauté scientifique et du grand public, par le biais de conflits parfois contre-productifs, sur les effets et la sécurité de ces composés dans l’organisme. Parmi ces questions, la cinétique des adjuvants et les effets indésirables chroniques potentiels, en particulier lorsqu’ils sont administrés tôt dans la vie, sont dignes d’intérêt [
Il est à noter que les études épidémiologiques évaluant les liens entre la vaccination et les DND n’ont pas spécifiquement abordé l’exposition aux adjuvants aluminiques, car la plupart d’entre elles se sont concentrées sur les vaccins sans aluminium (rougeole, oreillons et rubéole, ROR) [
L’utilisation croissante d’adjuvants aluminiques dans les vaccins administrés avant l’âge de 12 mois et les preuves croissantes de la neurotoxicité potentielle des adjuvants aluminiques découvertes jusqu’à présent nous amènent à rappeler l’évolution des vaccins contenant de l’aluminium. Nous passons en revue les études précliniques et cliniques qui s’interrogent sur leur rôle dans les interactions neuro-immunitaires au cours du développement cérébral dans le contexte des TSA. En effet, les TSA se classent systématiquement au premier rang des TND en ce qui concerne la contribution génétique relative, y compris les interactions épigénétiques et gène-environnement (GxE) [
Au cours des 20 dernières années, malgré l’extraordinaire hétérogénéité étiologique, la recherche des gènes des TSA a connu un succès remarquable. Plus de 100 mutations rares (souvent de novo) à effet important ont été identifiées dans le génome codant. À l’heure actuelle, les études de séquençage par microarray et d’exome entier se concentrent sur les variants rares, avec un soutien statistique convaincant à l’association d’une douzaine de variants du nombre de copies (VNC) et de plus de 100 gènes, un nombre en pleine expansion. Des études plus récentes portant sur de vastes cohortes cas-témoins ont identifié avec succès des associations avec des allèles à risque commun d’effet modeste, rendant possible la quantification des risques génétiques communs cumulés (score de risque polygénique) pour aborder l’hérédité polygénique. De plus, des preuves substantielles montrent que certains facteurs environnementaux pourraient entraîner des altérations des marques épigénétiques, augmentant le risque de troubles neurodéveloppementaux associés aux TSA et à leurs comorbidités [
Le lien entre l’immunogénétique, l’inflammation et les TSA est particulièrement bien établi. Par exemple, les infections maternelles périnatales sont reconnues depuis longtemps comme un facteur de risque important pour le développement des TSA chez l’enfant [
], augmentant la contribution potentielle de l’activation immunologique précoce Les composés immunitaires tels que les cytokines et les chimiokines et les cellules qui les produisent dans le système nerveux central (SNC), en particulier la microglie, sont connus pour avoir une fonction importante dans la maturation cérébrale norma De plus, un lien de causalité est démontré entre les TSA et une production cellulaire accrue d’interleukine-6 (IL-6)lors de l’activation immunitaire. Des niveaux accrus de cytokines inflammatoires dans le liquide céphalorachidien des patients atteints de TSA ainsi qu’une neuroinflammation dans le cerveau post-mortem de personnes atteintes de TSA ont également été décrits Français Dans ce contexte, un sous-ensemble de 35 patients adultes atteints de TSA de haut niveau présentent un processus inflammatoire/d’activation chronique des cellules tueuses naturelles, suggérant une hyperactivation cellulaire [
De plus, une régulation positive des inflammasomes NLRP3 et une surproduction de cytokines pro-inflammatoires (IL-1β et IL-18) ont été décrites dans les cellules mononucléaires du sang périphérique (PBMC) des enfants atteints de TSA par rapport aux témoins [
Français Malgré les limites existantes entre les modèles humains et animaux, les études précliniques contribuent de manière significative à faire la lumière sur les mécanismes moléculaires et cellulaires qui interviennent dans les aspects immunitaires du développement cérébral normal et pathologique [
De plus, des études sur des rongeurs ont démontré que le dysfonctionnement immunitaire, y compris l’inflammation centrale et périphérique pendant les périodes périnatales (neuroinflammation, production accrue de cytokines ou d’anticorps inflammatoires, activation des cellules immunitaires et auto-immunité), a un impact sur la trajectoire neurodéveloppementale de circuits clés dans la physiopathologie des TSA [
Plus récemment, des études cliniques et précliniques ont mis en évidence l’implication du système du complément, un acteur clé de l’immunité innée, dans les TND, y compris les TSA [
En conséquence, un nouveau paradigme a émergé dans le domaine de « l’immuno-neuropsychiatrie », décrivant une dysrégulation immunologique persistante dans la pathogenèse d’un large éventail de troubles neuropsychiatriques (pour une revue, voir [
2.4. Système immunitaire et environnement : un point de convergence
Français Les récentes avancées majeures dans le domaine des TSA suggèrent que le système immunitaire agit comme un point de convergence entre les facteurs de stress génétiques et environnementaux liés aux TSA [
Le système immunitaire est notre lien avec le monde extérieur et, par conséquent, les influences environnementales qui affectent les voies immunitaires maternelles, fœtales et/ou néonatales pourraient provoquer des altérations neuro-immunes distinctes chez l’individu en développement [
L’activation du système immunitaire résultant de l’exposition à des composés externes pro-inflammatoires pendant les périodes critiques pourrait entraîner des effets permanents et augmenter le risque de TND, suggérant que l’inflammation elle-même représente un facteur de stress environnemental précoce [
.Cela conduit à la question de savoir comment les voies liées à l’inflammation, y compris l’autophagie (voir ci-dessous), pourraient être responsables des impacts des facteurs environnementaux précoces dans le TSA, en particulier dans le contexte de la susceptibilité génétique.
3. Autophagie
L’autophagie est un mécanisme cellulaire hautement régulé et conservé, nécessaire à la survie cellulaire. En favorisant le recyclage des organites et des protéines à longue durée de vie [
]. L’autophagie neuronale est essentielle à l’élagage synaptique précoce, le processus de développement par lequel plus de 70 % des épines réseau postnatales sont éliminées au cours du cours normal de la maturation cérébrale pour assurer la formation pertinente de connexions neuronales appropriées [
De même, dans les études précliniques :1. Les voies d’autophagie microgliale altérées étudiées chez la souris ont conduit à un élagage synaptique défectueux, qui devient visible par une densité anormalement élevée des épines dendritiques [

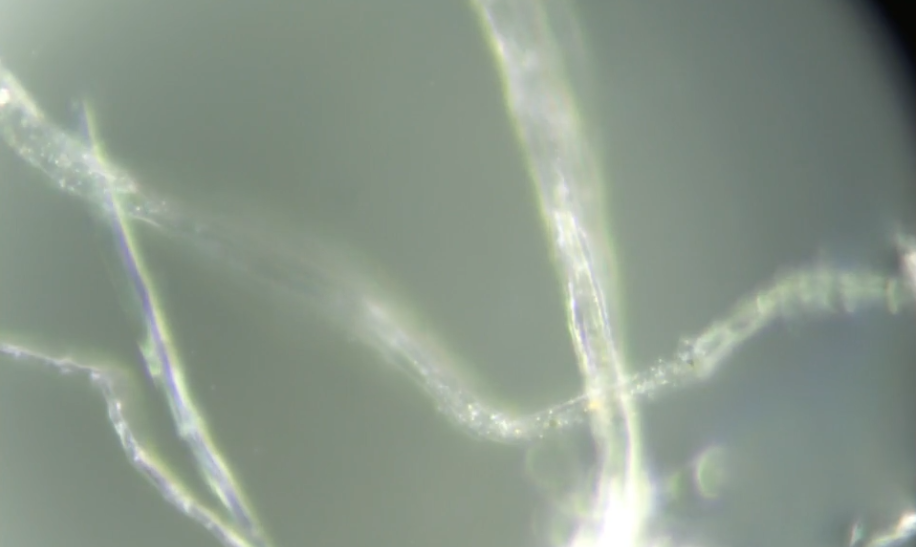
Figure 1. Analyse TEM des particules d’Al dans les suspensions commerciales (
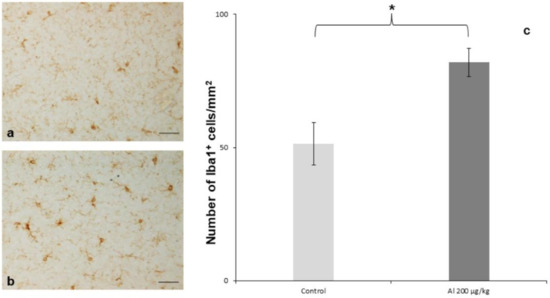
Figure 2. Densité des cellules microgliales Iba1+ dans le prosencéphale ventral. L’immunomarquage Iba-1 a montré une légère augmentation de la densité des cellules microgliales dans le groupe de souris injectées avec Alhydrogel
® 200 µg Al/kg. (
a ) Souris témoins injectées avec du PBS ; (
b ) souris injectées avec Alhydrogel
® 200 µg Al/kg ; (
c ) quantification de la densité des cellules microgliales. Trois souris/groupe ; résultats exprimés en moyenne ± SEM, test ANOVA avec test de Bonferroni post-hoc, *
p < 0,05 ; barres d’échelle : 50 µm. Réimprimé et adapté de [
164 ].Enfin, une publication récente a montré que les molécules régulatrices immunitaires étaient significativement élevées dans le cerveau après un défi immunologique périphérique induit après une injection précoce de vaccins contenant de l’aluminium ou d’oxyhydroxyde d’aluminium seul chez le rat [
183 ]. De plus, l’impact du sexe et du contexte génétique sur les réactions des cytokines et des chimiokines, ainsi que sur l’astrogliose et la microgliose dans le cerveau, est mis en évidence dans cette étude.
4.4. Modulation de l’autophagie par les particules d’aluminium
Français Outre son rôle dans l’élagage synaptique et le neurodéveloppement, la xéno/autophagie joue également un rôle central dans le mécanisme de dégradation cellulaire des particules minérales incorporées par endocytose [
66 ,
209 ]. Dans des études sur la souris et le poisson zèbre, l’exposition à des nanoparticules d’Al entraîne des altérations de l’expression des protéines liées à l’autophagie, associées à des troubles du comportement, parfois selon la taille des particules [
210 ,
211 ]. Comme d’autres métaux, nanomatériaux et nanomatériaux métalliques, les ABA exercent certains effets inhibiteurs sur le processus autophagique par déstabilisation lysosomale [
205 ,
212 ,
213 ,
214 ]. La biopersistance de l’Al pourrait être liée à son action déstabilisatrice des lysosomes, qui pourrait être causée par une fracture directe des membranes phagolysosomales induite par les cristaux [
123 ,
205 ,
214 ]. Une fois que les particules sont transférées dans les autophagosomes à double membrane, puis fusionnées avec les lysosomes reconstruits et réacidifiés, l’Al est exposé au pH acide lysosomal, étant la seule condition capable de dissoudre les particules d’Al [
123 ].Français Les biopsies des patients atteints de MMF ont révélé que les particules d’adjuvant Al à l’intérieur des macrophages sont au moins partiellement entourées d’une couche ressemblant à une membrane autophagosomale [
21 ,
89 ,
215 ]. Le recrutement par le phagophore de la protéine de chaîne légère cytosolique 3 (LC3) entraîne la formation d’un autophagosome, une double membrane vésiculaire qui engloutit les particules ingérées ainsi que les mitochondries et les peroxysomes [
185 ,
216 ].Les données préliminaires sur la culture in vitro des PBMC de patients atteints de MMF exposés à l’oxyhydroxyde d’aluminium ou à des vaccins adjuvés à l’aluminium ont révélé des niveaux plus élevés d’une protéine clé capable de réguler négativement l’autophagie [
217 ].
4.5. Al, autophagie et BHE
Français L’aluminium et en particulier les ions Al
3+ peuvent facilement traverser la BHE et/ou endommager son intégrité, principalement en induisant un stress oxydatif [
218 ,
219 ,
220 ]. La translocation cérébrale des particules d’aluminium est significativement augmentée chez les souris présentant une BHE chroniquement altérée [
146 ]. De plus, il a été montré chez la souris que l’exposition aux particules de nanoalumine par l’artère carotide pouvait conduire à (i) un dépôt de particules dans les cellules endothéliales du cerveau et une accumulation dans le cerveau, (ii) une augmentation de l’expression des gènes associés à l’autophagie et de l’activité autophagique dans le cerveau, (iii) une diminution de l’expression des protéines de jonction serrée, et (iv) une augmentation de la perméabilité de la BHE, suggérant que l’autophagie est un mécanisme clé dans les effets toxiques neurovasculaires médiés par la nanoalumine dans le SNC [
221 ].
4.6. ABA et TSA : quels sont les faits ?
L’exposition à l’ABA pendant les premiers mois de vie présente deux risques : une toxicité directe des particules pour les systèmes immunitaire et nerveux, et des effets indésirables causés par l’activation des réponses immunitaires pendant ces périodes critiques du développement. En particulier, le modèle à coups multiples décrit précédemment dans la présente revue semble adapté aux multiples activations immunitaires consécutives dues au calendrier vaccinal au cours des premières semaines/mois de vie [
206 ]. Plusieurs études ont ainsi suggéré que l’exposition à l’ABA pourrait être insidieusement nocive pour certains enfants à court et à long terme, contribuant à l’augmentation considérable des troubles neurodégénératifs, en particulier des TSA, à un jeune âge [
23 ,
108 ,
154 ,
163 ,
167 ,
169 ,
208 ,
219 ,
222 ,
223 ,
224 ,
225 ] (pour une revue, voir [
226 ]). Les principaux arguments en faveur de cette hypothèse sont les observations suivantes :Dans les études sur l’homme, d’une part :1. Tomljenovic et Shaw [
227 ] ont décrit une corrélation entre l’exposition accrue aux ABA et l’augmentation de l’incidence des TSA aux États-Unis, et une association entre la quantité d’aluminium fournie entre 3 et 4 mois et l’incidence des TSA dans sept pays occidentaux. De plus, le report de la première vaccination contre l’hépatite B dès le premier mois de vie pourrait diviser par trois l’incidence du diagnostic de TSA chez les garçons [
228 ]. Étant donné que les nourrissons de cette étude sont nés avant le retrait du mercure des vaccins, des doutes persistent quant à l’impact particulier de l’exposition précoce au mercure, à l’aluminium ou à la combinaison de mercure et d’aluminium sur les TSA.2. Mold et ses collègues [
224 ] ont utilisé la spectroscopie d’absorption atomique dans un four à graphite transversal pour déterminer la concentration d’Al dans le tissu cérébral post-mortem de TSA. Des moyennes de 2,30 à 8,74 μg Al
3+ /g ont été rencontrées, représentant certaines des valeurs les plus élevées pour Al dans le tissu cérébral humain jamais enregistrées. De plus, cette étude a également révélé une localisation intracellulaire d’Al dans des cellules de type microglie et d’autres cellules inflammatoires non neuronales dans les méninges, le système vasculaire, la matière grise et la matière blanche (
Figure 3 ) [
224 ]. De telles observations ne peuvent être faites qu’après la mortem et ne permettent pas d’identifier l’origine environnementale précise de l’Al. Cependant, elles fournissent des indices sur les mécanismes cellulaires partagés – tels que l’excitotoxicité immunitaire – entre la teneur en Al neuronal et les TSA.
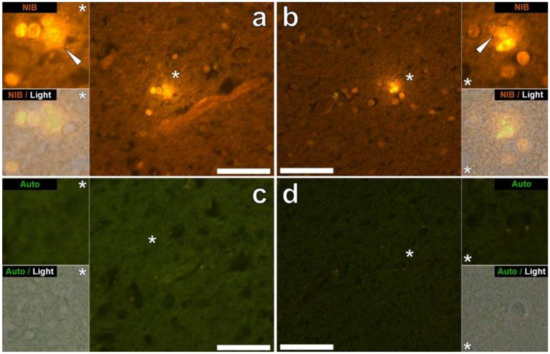
Figure 3. Aluminium intracellulaire dans des cellules morphologiquement compatibles avec la microglie dans les lobes pariétaux et temporaux de donneurs masculins de 29 ans (A8) et de 15 ans (A4) diagnostiqués autistes. De l’aluminium extracellulaire réactif au lumogallion (flèches blanches) produisant une émission de fluorescence orange a été observé autour de cellules microgliales probables dans les lobes pariétaux (
a ) et temporaux (
b ) des donneurs A8 et A4, respectivement. Des coupes sériées adjacentes non colorées (5 μm) ont produit une faible émission d’autofluorescence verte de la zone identique imagée dans la matière blanche (
c ) et grise (
d ) des lobes respectifs. Les panneaux supérieur et inférieur représentent des inserts agrandis, marqués par des astérisques, du canal de fluorescence et de la superposition en fond clair. Grossissement × 400, barres d’échelle : 50 μm. Copyright Elsevier (2018) [
224 ].Français D’autre part, des études précliniques sur des modèles de rongeurs ont clairement démontré que des réactions immunitaires accrues pendant la petite enfance peuvent induire des comportements de type autistique [
41 ,
42 ,
43 ]. Ces réactions immunitaires peuvent être causées par un effet toxique sur le système immunitaire pendant le développement ou par une stimulation précoce intense (et/ou répétée) de celui-ci. Des études sur des modèles murins pendant les premiers stades du développement postnatal ont montré que les adjuvants Al peuvent avoir un impact négatif sur le comportement social [
163 ,
167 ,
169 ]. Il a été récemment rapporté que l’injection intrapéritonéale du vaccin contre l’hépatite B pendant les trois premières semaines de vie interférait avec le développement du cerveau de la souris (comportement altéré, potentialisation hippocampique à long terme, neurogenèse diminuée, activation microgliale et profil pro-inflammatoire de l’expression des cytokines dans l’hippocampe), probablement médiée par l’IL-4 [
207 ,
208 ]. Français De plus, un modèle de mouton adulte a également démontré qu’après des injections répétées d’ABA ou de vaccins contenant de l’ABA, les animaux présentaient des comportements anormaux, tels qu’une agressivité et des stéréotypies accrues, et une interaction sociale affiliative diminuée [
168 ]. De plus, les niveaux accrus d’IL-6 signalés dans le sang et le cerveau des rongeurs exposés aux ABA [
183 ,
193 ,
194 ] sont particulièrement intéressants en raison du rôle de cette interleukine comme médiateur important des comportements de type autistique [
60 ].Français À la suite de ces éléments de preuve (données épidémiologiques, cliniques et précliniques) indiquant une association causale potentielle entre une exposition précoce à l’ABA et un risque accru de TSA [
226 ], de nouvelles hypothèses concernant les conséquences neurologiques et immunologiques des vaccins contenant de l’ABA et de nouvelles stratégies cliniques (c’est-à-dire le report des vaccins contenant de l’ABA et le remplacement des ABA par du phosphate de calcium) sont maintenant envisagées [
225 ,
229 ]. (Le phosphate de calcium a été utilisé en France jusqu’au milieu des années 1980 principalement pour le groupe vaccinal diphtérie-coqueluche-tétanos, sans aucune mention d’effets indésirables par les médecins. Jusqu’au début des années 1970, il a également été utilisé avec succès dans les vaccinations humaines pentavalentes (variole, fièvre jaune, rougeole, BCG et tétanos), également sans aucun effet indésirable signalé [
230 ]. Pour une revue sur le phosphate de calcium, voir [
231 ]).Français Pendant ce temps, la vaccination pendant la grossesse est actuellement recommandée dans le monde entier (par exemple, contre la coqueluche), parfois pour chaque grossesse [
232 ,
233 ,
234 ]. Cinq vaccins contre la coqueluche sont actuellement disponibles, tous contenant des ABA (oxyhydroxyde d’aluminium, phosphate d’aluminium ou un mélange des deux) [
234 ,
235 ]. En ce qui concerne la toxicité neurodéveloppementale de l’ABA discutée dans cette revue, cette exposition prénatale soulève des questions en plus du modèle d’activation immunitaire maternelle discuté précédemment, liées (1) au très faible nombre d’études portant sur l’exposition prénatale aux ABA (à notre connaissance, jusqu’à présent, seules deux études sur des rats exposés prénatalement au vaccin contre le VPH contenant de l’aluminium ou à l’adjuvant sulfate d’hydroxyphosphate d’aluminium ont été réalisées jusqu’à présent, toutes deux par l’industrie du vaccin [
]) ; de plus, (2) le transfert placentaire vers les tissus du fœtus (y compris le cerveau) de composés d’aluminium, chez les humains et les animaux, a été décrit [
], alors qu’il n’existe pas de données cliniques disponibles abordant cette question spécifiquement pour les ABA.Français Considérant que (i) l’autophagie est susceptible d’être perturbée dans les cerveaux atteints de TSA, (ii) cette perturbation pourrait altérer la clairance de l’ABA, (iii) les ABA sont des particules pro-inflammatoires persistantes dans l’environnement précoce des bébés, (iv) les ABA pourraient se déplacer de manière significative vers le cerveau avec une BHE immature, altérant le processus d’autophagie et favorisant la neuroinflammation, et (v) qu’il n’existe aucune preuve pour soutenir que les ABA sont totalement sûrs à utiliser chez les enfants, nous pensons que des recherches supplémentaires devraient aborder le lien potentiel entre les ABA et les NDD [
notamment :
- Études épidémiologiques comparant différents calendriers de vaccination et l’exposition à l’ABA chez les enfants ;
- Études génétiques de populations à risque, ciblant potentiellement des gènes candidats dans les voies immunitaires et autophagiques ;
- Pharmacocinétique et pharmacodynamique des adjuvants aluminiques pendant les périodes pré- et postnatales, dans des modèles animaux ;
- Données immunologiques fondamentales afin de mieux comprendre les mécanismes d’action immunitaire des ABA, en plus de leur éventuelle capacité à induire une neuroinflammation et des altérations des interactions immuno-neuronales au cours de la vie postnatale précoce, par exemple en utilisant des modèles de souris déficientes en autophagie.
5. Conclusions
La présente revue s’est concentrée sur les TSA, mais le lien entre l’altération de l’autophagie, le neurodéveloppement et l’exposition précoce aux adjuvants aluminiques pourrait s’appliquer à d’autres troubles neuropsychiatriques, notamment le SZ et le BD, désormais considérés comme des pièces du même puzzle plutôt que comme des entités distinctes (partageant des manifestations cliniques, des gènes de vulnérabilité et des mécanismes) [
.Notre revue souligne l’absence de données scientifiques fondamentales démontrant l’innocuité des adjuvants aluminiques et leur absence d’effets secondaires à long terme. Elle plaide également en faveur de recherches plus approfondies sur les effets d’une exposition précoce aux adjuvants aluminiques, associée à des facteurs de susceptibilité génétique, notamment les gènes de l’autophagie, du système immunitaire et de l’inflammation. De plus en plus de données montrent que la modulation des niveaux d’autophagie peut augmenter le risque de TND. Ces études permettront d’élucider une nouvelle étiologie de ces troubles complexes et de contribuer au développement de nouveaux outils diagnostiques et thérapeutiques potentiels.


.png) 1 month_ago
92
1 month_ago
92




















 French (CA)
French (CA)