NE LAISSER PAS LE 5G DETRUIRE VOTRE ADN Protéger toute votre famille avec les appareils Quantiques Orgo-Life® Publicité par Adpathway
WASHINGTON – 26 mai 2024 –
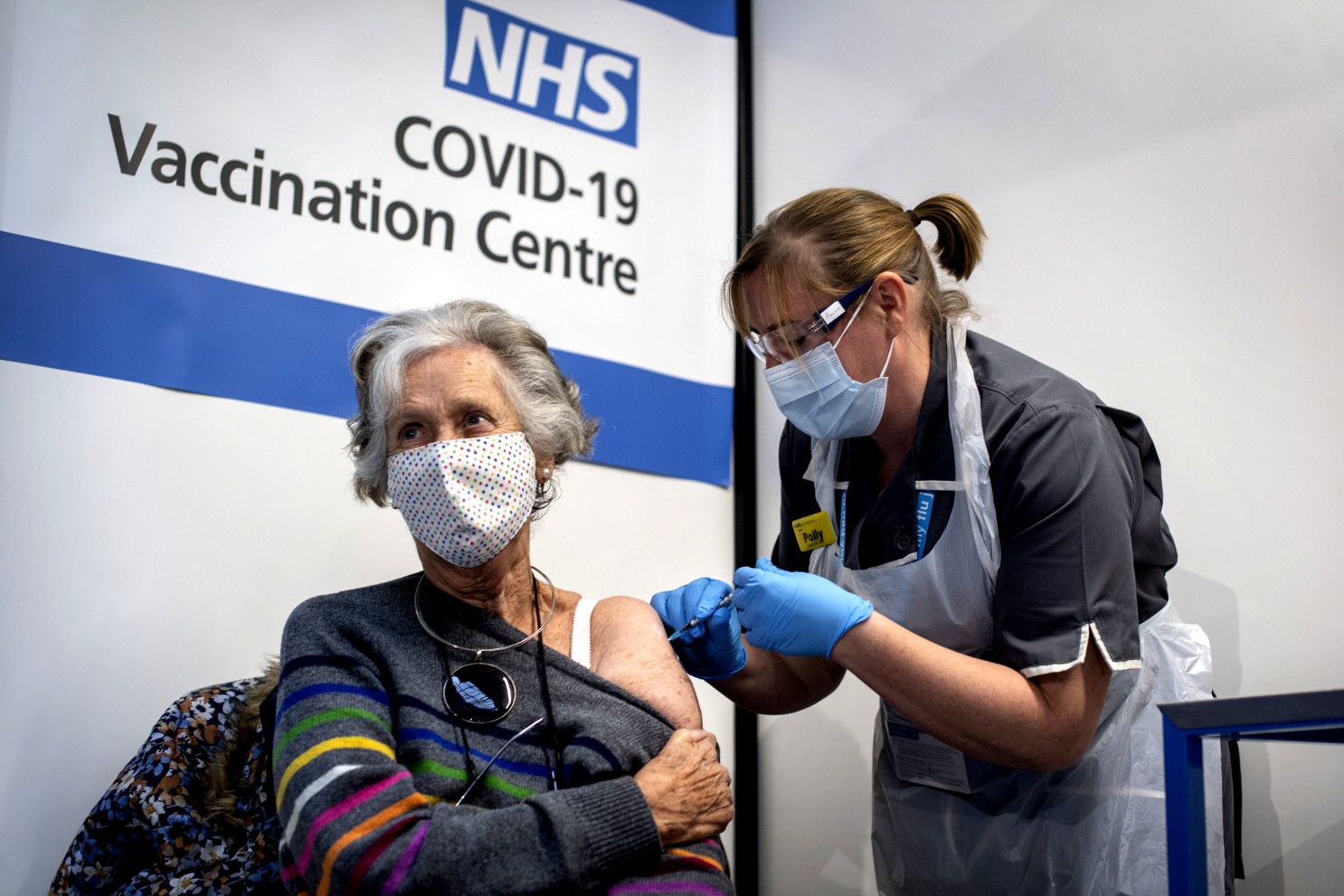
Les vaccins contre la COVID-19 sont au cœur des nouvelles orientations de la FDA. La Food adn Drug Administration (FDA) a annoncé des changements majeurs concernant l’approbation et l’administration des vaccins contre la COVID-19, impactant les critères et les recommandations.Ces modifications, analysées par des experts, visent à adapter les vaccins aux variants circulants. Pour en savoir plus sur ces changements significatifs, lisez la suite !
La Food and Drug Governance (FDA) a récemment annoncé des changements importants concernant l’approbation et l’administration des vaccins contre la COVID-19. Ces modifications, détaillées dans le New England Journal of Medicine par le commissaire de la FDA, Marty Makary, et Vinay Prasad, directeur du Center for Biologics Evaluation and Research (CBER), redéfinissent les critères d’approbation des vaccins et les recommandations pour les vaccins saisonniers.
Recommandations du VRBPAC pour la saison à venir
Dans ce contexte de changements majeurs, le Vaccines and Related Biological Products Advisory Committee (VRBPAC) de la FDA s’est réuni pour déterminer les souches de la COVID-19 à inclure dans les vaccins pour la prochaine saison respiratoire.
- Le comité a voté à l’unanimité en faveur d’un vaccin monovalent basé sur la lignée JN1.
- Des discussions ont suivi concernant la sélection de JN1 et/ou d’une souche spécifique de la lignée JN1 pour les vaccins COVID-19 (formule 2025-2026).
Le saviez-vous ?
La lignée JN1 est une sous-variante d’Omicron, caractérisée par une transmissibilité accrue. La sélection d’un vaccin monovalent JN1 vise à offrir une protection plus ciblée contre les souches circulantes.
Le comité consultatif a examiné les données disponibles sur la circulation des variants du SARS-CoV-2, l’efficacité actuelle des vaccins, les données d’immunogénicité humaine des vaccins actuels contre les variants récents, la caractérisation antigénique des variants circulants, les données d’immunogénicité animale sur les nouveaux vaccins candidats exprimant ou contenant des composants de pointe mis à jour, et les données d’immunogénicité humaine sur les vaccins COVID-19 (formule 2024-2025).
Sur la base de l’ensemble des preuves, la FDA a conseillé aux fabricants de vaccins COVID-19 approuvés que, pour mieux correspondre aux virus SARS-CoV-2 actuellement en circulation, les vaccins COVID-19 destinés à être utilisés aux États-Unis à partir de l’automne 2025 devraient être des vaccins monovalents basés sur la lignée JN1 (formule 2025-2026), en utilisant de préférence la souche LP81.
Réactions des cliniciens à la nouvelle politique vaccinale
Bien qu’il semble que la formulation des vaccins 2025-2026 n’aura pas besoin de passer par des essais cliniques, la politique à venir exigera des essais contrôlés par placebo pour les vaccins COVID-19 afin d’obtenir l’approbation de la FDA. Cela pourrait prendre des mois, ce qui rend très réelle la possibilité de ne pas être préparé pour une saison de virus respiratoires.
Conseil pratique
Restez informé des recommandations de votre professionnel de santé concernant la vaccination contre la COVID-19, surtout si vous avez plus de 65 ans ou si vous souffrez de problèmes de santé sous-jacents.
Sharon Nachman, chef du service des maladies infectieuses pédiatriques à l’hôpital pour enfants de Stony Brook, a déclaré : Un nouveau vaccin ne sera pas déployé à temps pour être utile pendant cette saison.Juste en jouant avec les chiffres, vous aurez besoin de plusieurs centaines de personnes pour être inscrites à une étude sur les vaccins et attendre de voir si elles ont des effets secondaires ou s’il y a des problèmes avec le vaccin ou le placebo, ce qui signifie qu’il doit passer par une saison.
En ce qui concerne l’admissibilité aux vaccins COVID-19, cette politique a radicalement changé. Alors qu’auparavant, il était recommandé à toutes les personnes âgées de 6 mois et plus de se faire vacciner, la FDA ne recommande plus la vaccination annuelle contre la COVID aux personnes en bonne santé de moins de 65 ans. Il est toujours recommandé aux personnes âgées de 65 ans et plus de se faire vacciner chaque année, ainsi qu’aux personnes âgées de 6 mois et plus qui ont des problèmes de santé sous-jacents tels que le diabète, le cancer, l’asthme, etc.
Pour ceux qui ne font pas partie de ces populations de patients,cela laisse aux cliniciens,aux familles et aux individus des questions sur l’accès et l’admissibilité.
Tina Tan,présidente de l’Infectious Diseases Society of America (IDSA),a déclaré dans une interview accordée à Contemporary Pediatrics : malheureusement,cela élimine pratiquement l’accès à la vaccination pour la majorité de la population pédiatrique. Et la COVID 19 est une maladie qui survient chez les enfants.Même s’il y a toutes ces fausses informations selon lesquelles la COVID 19 ne cause pas d’infection chez les enfants, mais c’est le cas… certains enfants peuvent en fait être assez malades et ils peuvent développer des symptômes de COVID longue durée.
Nachman voit également la complication potentielle de la COVID longue durée. Lorsque nous examinons les données sur les personnes qui ont contracté la COVID longue durée,non seulement chez les enfants,mais aussi chez les adultes,il existe maintenant des informations fascinantes provenant de plusieurs études selon lesquelles les personnes qui se sont fait vacciner avaient un risque beaucoup plus faible de COVID longue durée,a déclaré Nachman.
Cette nouvelle politique pourrait entraîner des retards dans le déploiement des vaccins à l’avenir.
Tan a déclaré : Cela va être un facteur majeur qui retardera la possibilité pour les individus de recevoir le vaccin, et ce n’est pas ainsi que cela devrait être fait, car nous savons que ces vaccins fonctionnent.Les vaccins sont reformulés chaque année pour tenir compte des sous-stéréotypes en circulation. Et vous savez, il n’est pas nécessaire de faire un essai clinique pour prouver que ces vaccins fonctionnent ; nous savons que les vaccins fonctionnent. Nous savons que les vaccins sont sûrs… vous allez vraiment retarder la disponibilité.
Les cliniciens soulignent que la limitation de l’accès sera un problème majeur pour certains qui souhaitent se faire vacciner, mais qui devront probablement maintenant payer pour cela.
Robert H. Hopkins jr, directeur médical de la NFID, a déclaré dans une déclaration à Contagion : Limiter l’accès généralisé aux vaccins mis à jour alors que la COVID-19 continue de circuler est un pari dangereux. Nous ne devons pas affaiblir nos défenses contre un virus qui constitue toujours une menace sérieuse pour la santé publique.
Question pour vous
Comment ces changements de politique de la FDA affectent-ils votre décision de vous faire vacciner contre la COVID-19 ?
FAQ sur les nouvelles politiques de la FDA concernant les vaccins contre la COVID-19
Qui est recommandé pour recevoir les vaccins COVID-19 annuels ? Les personnes âgées de 65 ans et plus, ainsi que celles de 6 mois et plus ayant des problèmes de santé sous-jacents. Pourquoi la FDA exige-t-elle des essais contrôlés par placebo pour les futurs vaccins COVID-19 ? Pour garantir la sécurité et l’efficacité des vaccins avant leur approbation. Quelle est la souche recommandée pour les vaccins COVID-19 à partir de l’automne 2025 ? La lignée JN1, en utilisant de préférence la souche LP81.Référence:
1. COVID-19 Vaccines (2025-2026 Formula) for use in the United States Beginning in Fall 2025. FDA. May 22,2025. Accessed May 23, 2025.


.png) 1 month_ago
13
1 month_ago
13


















 French (CA)
French (CA)