NE LAISSER PAS LE 5G DETRUIRE VOTRE ADN Protéger toute votre famille avec les appareils Quantiques Orgo-Life® Publicité par Adpathway
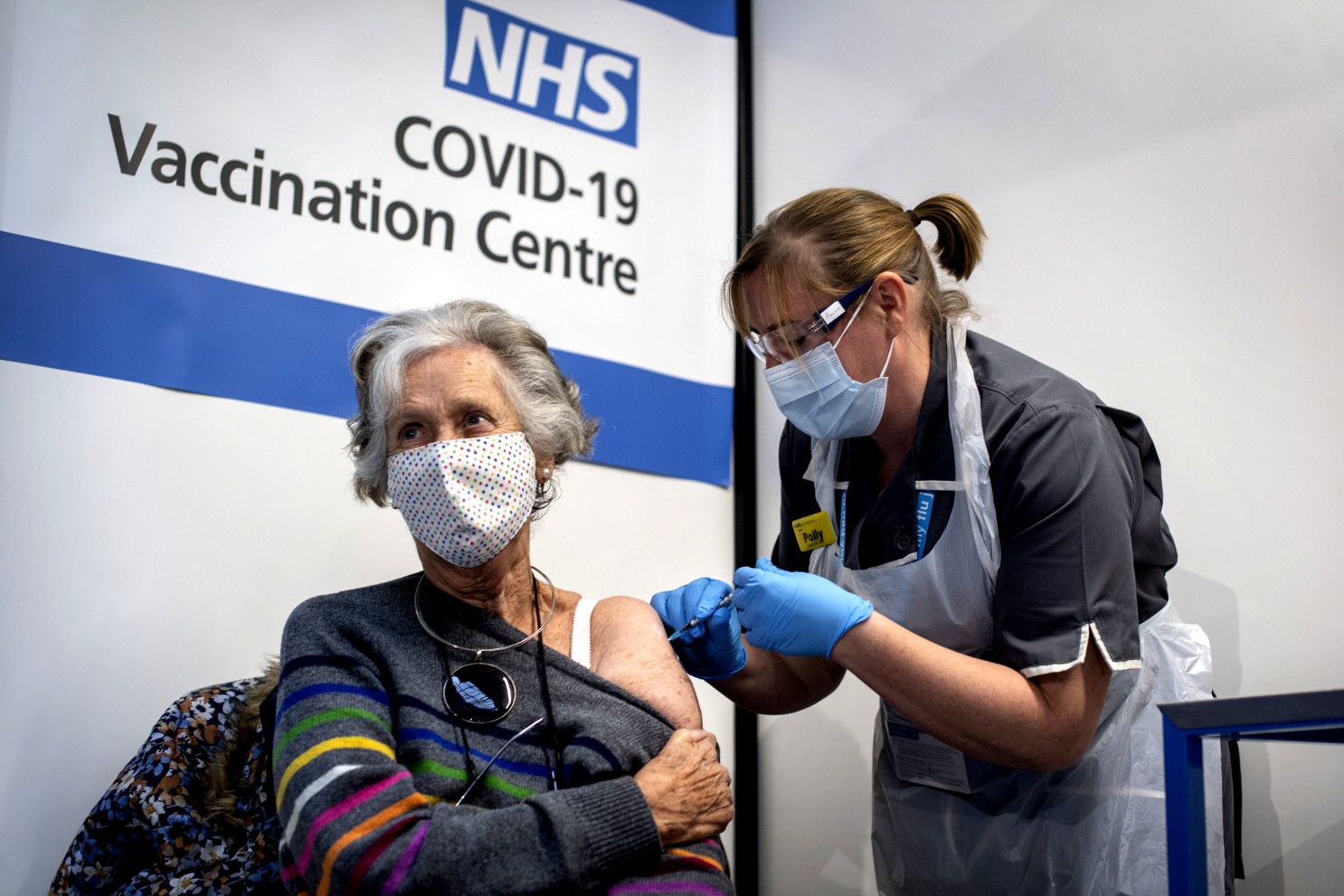
La récente décision de la FDA concernant le vaccin Novavax contre la COVID-19 marque un tournant dans la stratégie de vaccination aux États-unis.Elle limite son accès aux adultes plus âgés et aux personnes de plus de 12 ans présentant des conditions médicales préexistantes qui les placent à haut risque. Cette mesure, qui contraste avec les approbations précédentes des vaccins de Pfizer-BioNTech et Moderna, introduit un nouveau paradigme dans la disponibilité des vaccins contre la COVID-19, suscitant des débats sur l’avenir de l’immunisation et les implications possibles pour la santé publique.
La restriction imposée au vaccin Novavax pourrait avoir un impact significatif sur la disponibilité de cette option pour la population de moins de 65 ans sans comorbidités, laissant une partie de la société potentiellement vulnérable face à l’apparition de nouveaux variants. Cette décision pourrait également réduire les alternatives pour ceux qui recherchent le vaccin pour diverses raisons, y compris la protection des membres de la famille vulnérables.Cette décision de la FDA intervient à un moment où les conseillers scientifiques des Centres de contrôle et de prévention des maladies (CDC) délibèrent sur l’opportunité de recommander les vaccins contre la COVID-19 uniquement aux Américains les plus vulnérables. L’approbation du vaccin,appelé Nuvaxovid,implique que l’entreprise doit réaliser des études supplémentaires sur son association possible avec certaines affections cardiaques. L’une de ces enquêtes nécessiterait le suivi de milliers d’individus sains âgés de 50 à 65 ans, ce qui impliquerait un coût considérable.
Cette nouvelle position de la FDA semble également refléter un certain scepticisme à l’égard des vaccins. L’approbation du vaccin Novavax dans ces conditions représente un tournant dans les normes établies depuis l’approbation initiale des vaccins contre la COVID-19, étant la première fois que la FDA impose des critères de santé pour l’administration.
Des experts ont exprimé leur déception face à cette restriction.
« Un jour sombre dans la médecine américaine. »
Il est souligné que Nuvaxovid, basé sur une plateforme vaccinale plus traditionnelle, présente un profil d’effets secondaires généralement plus favorable, ce qui en fait une option intéressante pour ceux qui sont réticents aux vaccins ARNm de Pfizer-BioNTech et Moderna. malgré cela, selon les nouveaux critères, ni elle ni ses enfants ne seraient éligibles pour le recevoir.
Le directeur exécutif de Novavax a décrit l’approbation comme une « étape importante » qui consolide une voie pour que les personnes les plus susceptibles de rechercher une vaccination contre la COVID-19 reçoivent le vaccin de l’entreprise. Cependant, des doutes persistent sur les conditions spécifiques qui seront considérées comme sous-jacentes, ce qui pourrait générer de la confusion chez les consommateurs et entraver la couverture par les assureurs s’il est prescrit à des personnes en bonne santé de moins de 65 ans.
Un expert en vaccins a exprimé son inquiétude quant à l’objectif de rendre les vaccins moins accessibles, plus chers et plus craints, soulignant que son intention est de « démanteler l’infrastructure vaccinale » en raison de sa conviction qu’ils ne sont pas bénéfiques et ne sont que nuisibles. La FDA a signalé qu’une étude du vaccin Novavax est actuellement en cours chez les personnes de moins de 12 ans,tandis qu’un responsable de la FDA a annoncé la publication imminente d’un nouveau cadre pour évaluer les vaccins contre la COVID-19,anticipant une réunion pour sélectionner le variant du virus qui couvrira les vaccins d’automne.
Introduction
La récente approbation du vaccin Novavax par la FDA pour lutter contre la COVID-19 marque un changement significatif dans la stratégie de vaccination aux États-Unis. Cette décision, plus restrictive que les précédentes approbations des vaccins Pfizer-BioNTech et Moderna, soulève des questions importantes concernant l’avenir de l’immunisation et ses impacts sur la santé publique.
Restrictions et Conséquences
La FDA a limité l’accès au vaccin Novavax aux adultes plus âgés et aux personnes de plus de 12 ans ayant des conditions médicales préexistantes, les considérant comme étant à haut risque.
Cette restriction pose des problèmes pour :
Disponibilité: Réduit les options de vaccination pour les personnes de moins de 65 ans sans comorbidités.
Protection familiale: Limite les choix pour ceux qui souhaitent protéger les membres vulnérables de leur famille.
Efficacité face aux variants: Pourrait laisser une partie de la population potentiellement plus vulnérable face à l’apparition de nouveaux variants de la COVID-19.
Contexte et Débats
La décision de la FDA intervient alors que les CDC envisagent de recommander les vaccins COVID-19 uniquement aux Américains les plus vulnérables. L’approbation de Novavax est également conditionnée à des études supplémentaires sur d’éventuels liens avec des affections cardiaques, ce qui implique des coûts importants.
Scepticisme et Opinions D’experts
Cette nouvelle position de la FDA semble refléter un certain scepticisme à l’égard des vaccins. Des experts ont exprimé leur déception, qualifiant la restriction de “jour sombre dans la médecine américaine”.
Avantages potentiels du vaccin Novavax
Le vaccin Novavax, basé sur une plateforme vaccinale plus traditionnelle, pourrait avoir un profil d’effets secondaires plus favorable, ce qui peut être une option attrayante pour ceux hésitants vis-à-vis des vaccins ARNm.
Impact et Perspectives
Confusion et accessibilité: Le directeur exécutif de Novavax a souligné qu’il s’agit d’une “étape importante”, mais des incertitudes demeurent sur les conditions spécifiques d’éligibilité, ce qui pourrait créer de la confusion et des obstacles pour la prise en charge par les assureurs.
Démanteler l’infrastructure vaccinale? Un expert a exprimé son inquiétude quant à la tendance à rendre les vaccins moins accessibles, plus coûteux et suscitant plus de craintes.
Futures Études et developments La FDA mène actuellement des études sur le vaccin Novavax chez les moins de 12 ans.De plus, la publication imminente d’un nouveau cadre pour évaluer les vaccins COVID-19 et la sélection du variant viral pour la vaccination d’automne sont prévues.
tableau Récapitulatif : Comparaison des Approches de Vaccination
| Caractéristique | Vaccins Pfizer-BioNTech et Moderna (Approbations Précedentes) | Vaccin Novavax (Décision Récente de la FDA) |
| ———————————– | ———————————————————– | ——————————————————– |
| Cible principale | Population générale | Adultes plus âgés et personnes à haut risque |
| Disponibilité | Plus large | Restreinte |
| Restrictions d’âge et de santé | Moins de restrictions | Critères de santé pour l’administration |
FAQ sur le Vaccin novavax
Q: Qui est éligible pour se faire vacciner avec Novavax ?
R: Les adultes plus âgés et les personnes de plus de 12 ans avec des conditions médicales préexistantes.
Q: Pourquoi l’accès à Novavax est-il limité ?
R: La FDA souhaite mener des études sur d’éventuels effets secondaires et exprime une certaine prudence.
Q: Quels sont les avantages potentiels du vaccin Novavax ?
R: Il utilise une plateforme vaccinale plus traditionnelle, potentiellement avec moins d’effets secondaires pour certains.
Q: La décision de la FDA est-elle critiquée ?
R: Oui, certains experts ont exprimé leur déception et inquiétude.
Q: Que prévoit l’avenir pour les vaccins COVID-19 ?
R: De nouvelles directives sont attendues, ainsi que la sélection du variant viral pour les vaccins d’automne.


.png) 1 month_ago
8
1 month_ago
8


















 French (CA)
French (CA)